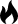由于单键可以“自由”的旋转,使分子中的原子或基团在空间产生不同的排列,这种特定的排列形式称为构象。由单键旋转产生的异构体称为构象异构体或旋转异构体。
一、乙烷的构象
当C2H6分子以C—Cσ键为轴进行旋转时,两个相邻碳原子上的C—H键会交叉成一定的角度θ,这个角度称为二面角。
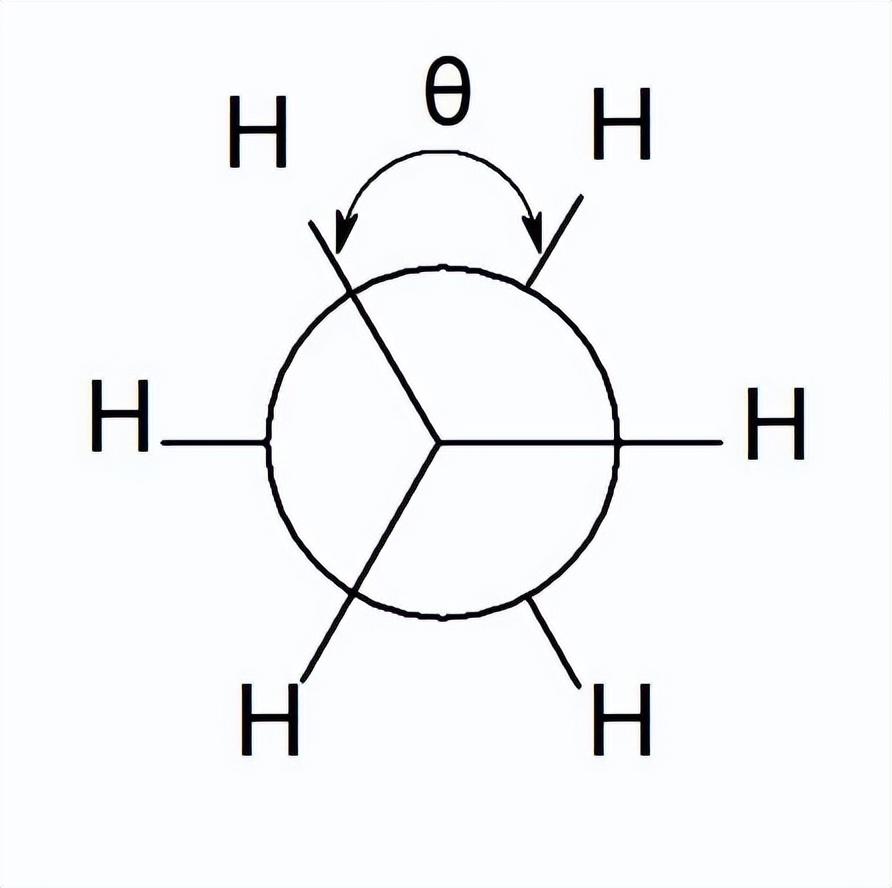
图1 乙烷分子中的二面角
单键旋转一周,可以产生无数个构象异构体,二面角为0°的构象称为重叠型构象;二面角为60°的构象称为交叉型构象。二面角在0°到60°之间的构象称为扭曲型构象。重叠型构象和交叉型构象是乙烷的两种极限构象。
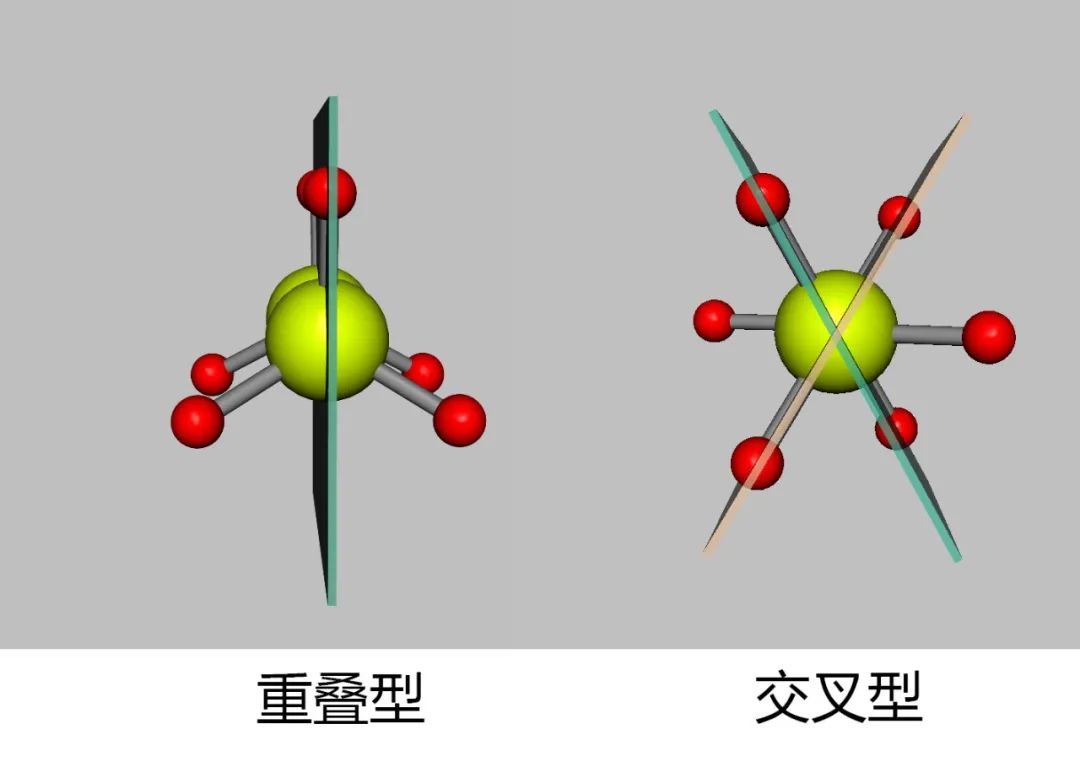
图2 乙烷分子的重叠型与交叉型构象
乙烷分子中,C—C键长为154pm,C—H键长为110.7pm,C—C—H键角109.3°。在乙烷的重叠型构象中,两个碳原子上的氢原子彼此是重叠着的。根据计算,它们之间的距离为229pm,而氢原子的范德华半径为120pm,两个氢核之间距离小于两个氢原子范德华半径之和,因此有排斥力。同时,旋转也会导致分子轨道相互作用的细微变化,在重叠型构象中轻微弱化C—C键使其键长变长,分子处于这种构象,从能量上考虑是最不稳定的。
在乙烷的交叉型构象中,两个碳原子上的氢离得最远,根据计算,两个氢核之间的距离约为250pm,从能量上看,分子处于这种构象是最稳定的。乙烷分子其它构象能量介于重叠型与交叉型之间,分子在可能的条件下,总是倾向于以能量最低的稳定的形式存在,一旦偏离稳定形式,非稳定构象受范德华斥力作用具有恢复成稳定构象趋势。
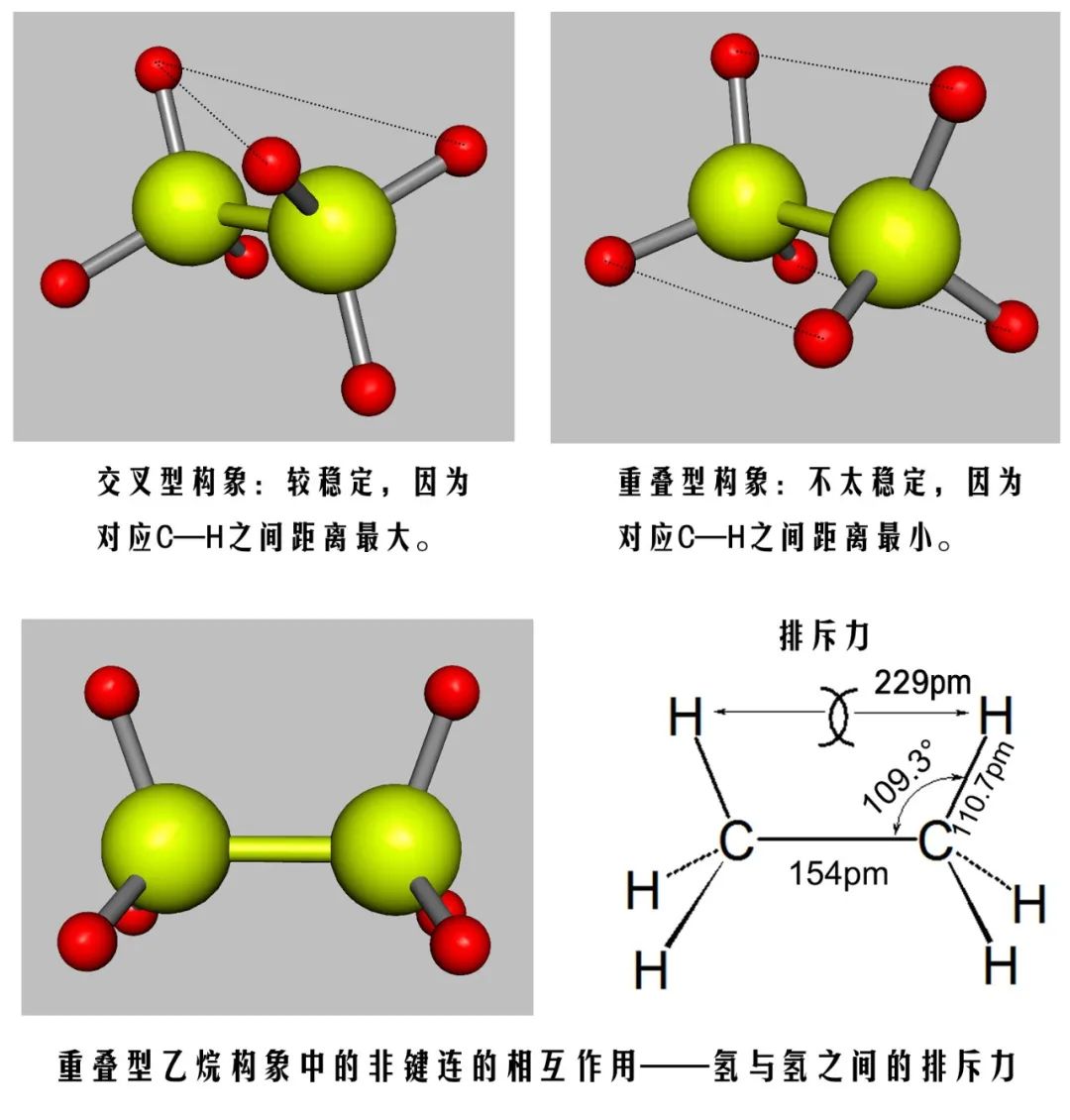
图3 重叠型与交叉型构象C—H之间距离
乙烷的重叠型构象与交叉型构象虽存在能差,但差别并不大,只需要12.1 kJ·mol-1,就由一个稳定的交叉型构象变成不稳定的重叠型构象,这种分子旋转时所必需的最低能量,称为转动能垒。因为转动能垒不大,而在室温,分子间的碰撞就可产生能量约84 kJ·mol-1,足以使分子“自由”旋转,因此不能分离这些构象异构体。
二、乙烷构象的表示方法
乙烷的构象,可用侧视图(图4)与端视图(图5)来表示:
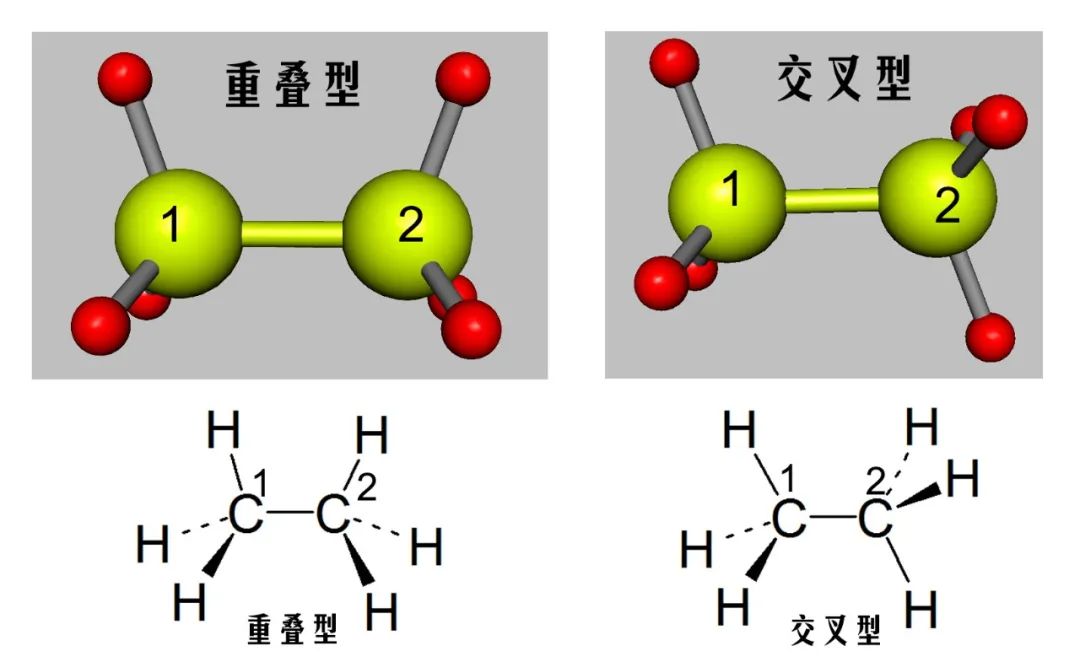
图4 乙烷构象侧视图
乙烷沸点
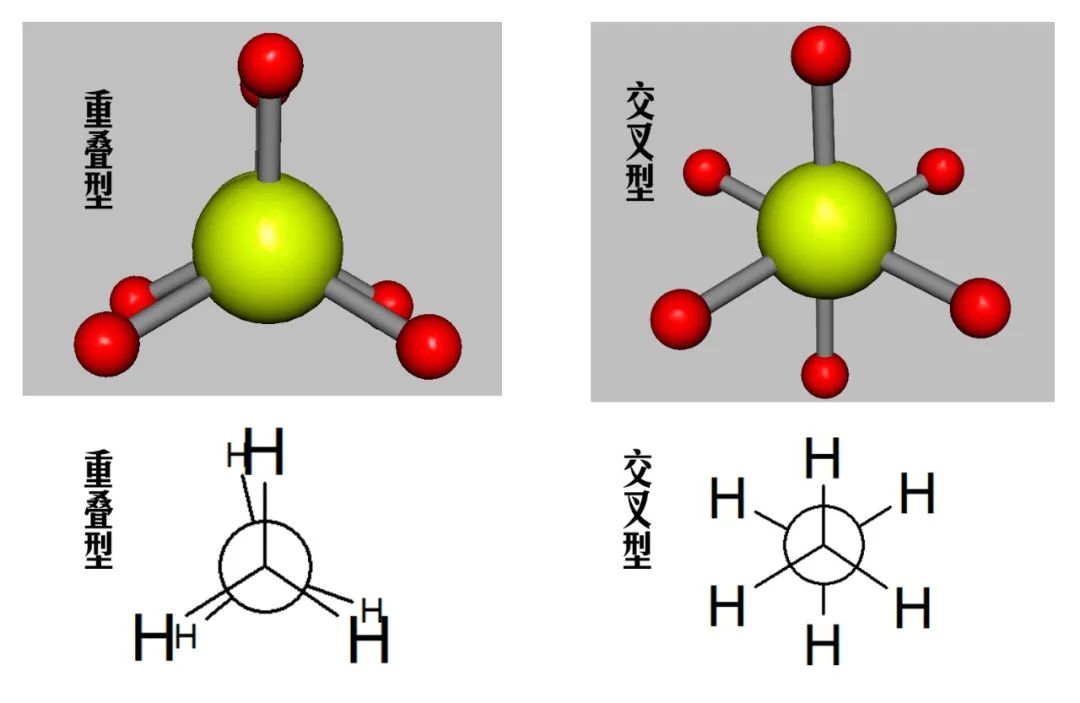
图5 乙烷构象端视图纽曼投影式
侧视图是眼睛垂直于C—C键轴方向看,实线表示键在纸面上,虚线表示键伸向纸面后方,楔形线表示键向纸面前方;乙烷端视图常用纽曼投影式表达,纽曼式是从C—C键的轴线上看,在纽曼式中,前面的碳原子(C-1)用表示,后面的碳原子(C-2)用表示。重叠型C-1上的氢与C-2上的氢是重叠着的,应该看不到,但为了表示出来,稍偏一个角度。
三、乙烷的构象势能关系图
乙烷的各种构象异构体具有不同势能,若以单键的旋转角度为横坐标,以各种构象的势能为纵坐标。如果将单键旋转360°,就可以画出一条构象的势能曲线,如图6所示。
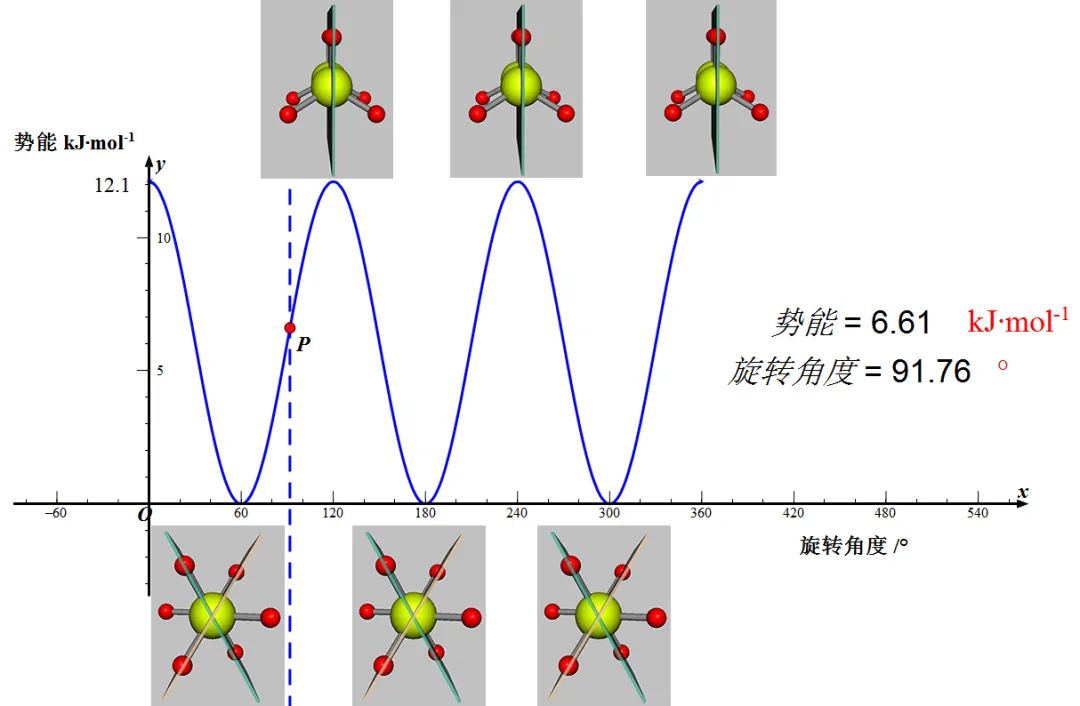
图6 乙烷转动异构过程的势能图
图中曲线上的任何一点代表一种构象及其势能,位于曲线中最低的一点,即谷底势能最低,它所代表的交叉型构象最稳定,任何分子在稳定的构象中呆的时间最长,只要稍微离开谷底一点就意味着势能的升高,分子就变得不稳定一些,位于曲线中最高的一点,即峰顶的势能最高,代表的重叠型构象最不稳定,它的存在时间非常短,小于10-12s,事实上重叠型构象只是快速平衡的交叉型构象的一个过渡状态。构象特征会影响分子的化学反应性。
如果将温度逐步降低,分子“自由”旋转逐渐困难,最后不能“自由”旋转,用X射线衍射分析方法及核磁共振方法测定表明,乙烷分子在低温时的优势构象,是最稳定的交叉型构象。
转自 菏泽西冷化工有限公司 www.sirloong.com