来源:药智网公众号

图片来源:摄图网
河马信号通路(Hippo pathway)是最早在果蝇中鉴定出的一条肿瘤抑制通路,当河马信号通路发生异常被关闭时会导致多种癌症恶化。
YAP和TEAD是河马信号通路中两个重要的转录因子,YAP和TEAD的相互作用是河马信号通路中一个关键的调节步骤。
抑制YAP和TEAD的相互作用,是治疗癌症的一种有希望的策略。
01
最新!TEAD抑制剂研究进展
最近,河马通路之父管坤良教授在自然综述介绍了河马通路的生物学背景以及癌症治疗领域的最新进展。
下图描述了河马通路的主要角色之间的关系:河马信号通路由LATS1和LATS2激活,它们通过磷酸化YAP和TAZ将其保留在细胞质中。
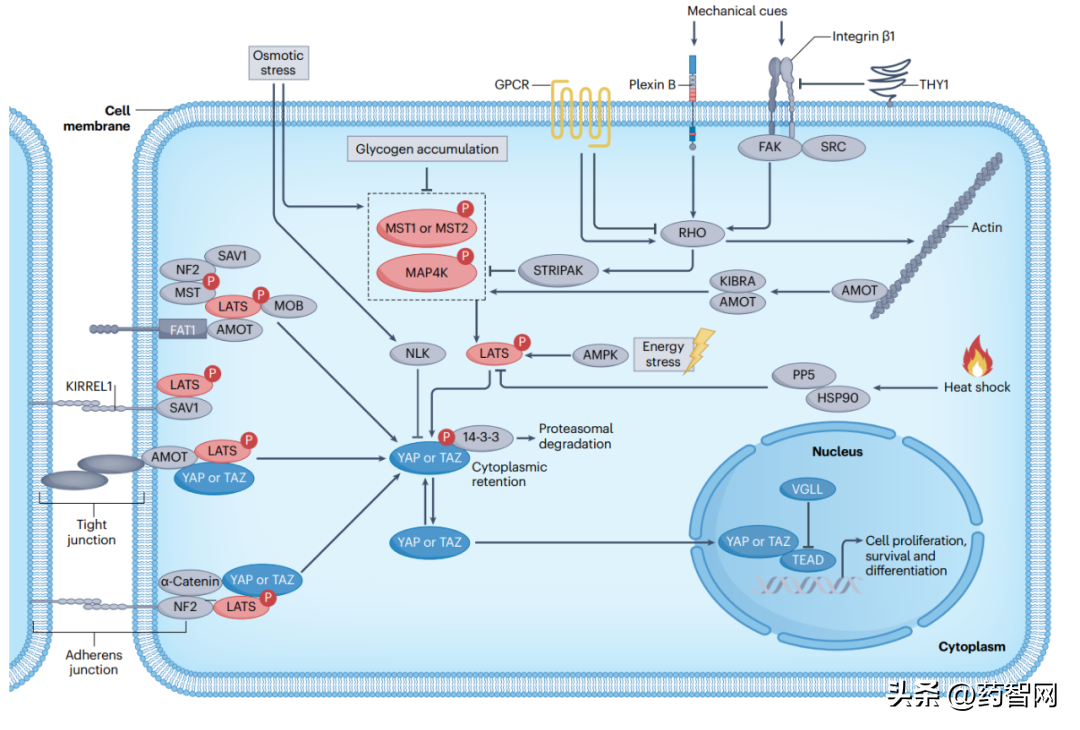
图1 典型的河马信号通路示意图
图片来源:参考资料1
当LATS1和LATS2被抑制时,YAP和TAZ可以被释放到细胞核中,并与TEAD转录因子结合,调节基因的表达。YAP和TAZ是转录因子,它们通过与细胞核中的下游蛋白TEAD转录因子结合来调节基因的表达。
此图为我们提供了一个全面的视图,对于理解河马通路在细胞增殖、存活和分化中的作用以及它们在癌症中的作用具有重要意义。
YAP–TEAD结合需要在TEAD的中央口袋中对半胱氨酸残基进行棕榈酰化(palmitoylation)才能刺激转录。棕榈酰化是一种脂质修饰,涉及将棕榈酰基(棕榈酸的酰基)附加到蛋白质的半胱氨酸残基上。棕榈酰化可以影响蛋白质的折叠、定位和功能。
在YAP中,棕榈酰化在调节蛋白的核定位中起重要作用。当YAP被棕榈酰化时,它会被定位到细胞膜,并在那里发挥作用。当YAP被去棕榈酰化时,它会被释放到细胞质中,并失去活性。
已经有许多抑制天然物抑制剂和设计出来的化合物(VT107,VT3989,TED-347,IK-930)来抑制TEAD棕榈酰化并最终抑制YAP转录。
比如VT3989就是一种靶向TEAD棕榈化口袋的别构抑制剂,在恶性间皮瘤和其他携带NF2突变的实体瘤患者中表现出持久抗肿瘤活性和耐受性。
另外YAP–TEAD复合体有三个结合界面(Interface 1,2,3)。利用多肽或者小分子与YAP直接竞争TEAD的结合,抑制YAP的活性就可以阻止YAP–TEAD复合物的形成比如多肽化合物Super-TDU,peptide 17和金黄三羧酸(aurintricarboxylic acid)阻断。
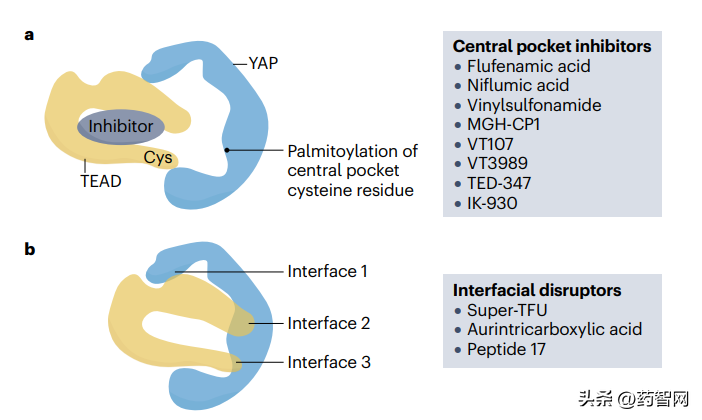
图2 当前的治疗候选药物主要集中在间接抑制TEAD内部的口袋(比如VT3989)或者直接破坏YAP–TEAD蛋白质互动表面(比如诺华的IAG933)
图片来源:参考资料1
笔者也跟据文献和专利,整理了目前TEAD的抑制剂的结合口袋和化学结构:
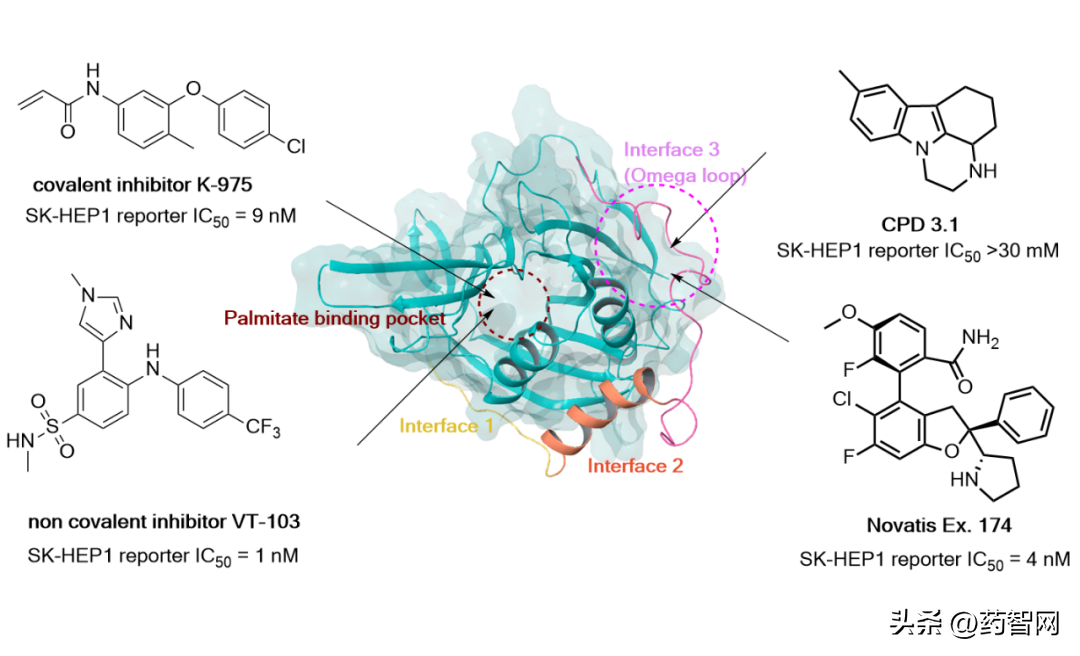
图3 靶向不同口袋的YAP-TEAD的抑制剂代表结构(作者制图)
诺华团队近几年连发了两篇论文,详细介绍了他们如何参考MDM2-P53类似案例合成团队和计算机药物设计团队通力合作把IC50=267微摩尔的小分子片段优化到IC=2纳摩尔的临床化合物的故事:
通过分析多肽类抑制剂的药物分子特征和关键的结合界面相互作用,利用这些信息来指导小分子化合物的转化。分子动力学模拟分析结果提供了宝贵的见解,这些见解有助于了解导致化合物系列中效力提高的构象动力学和热力学因素。
此外,严格的结合自由能计算结果与实验结果有很好的相关性,这表明这些方法可以用来提供定性排序和定量评估结合亲和力,以指导化学物质设计工作。
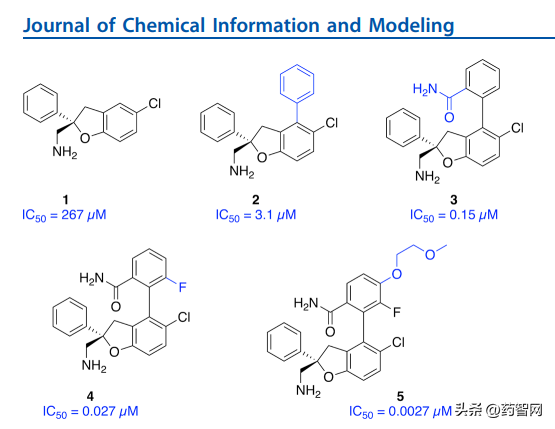
图4 通过分子动力学和CADD辅助设计优化TEAD抑制剂的故事
图片来源:参考资料2
其中,靶向TEAD-YAP蛋白质蛋白质相互作用表面的抑制剂代表化合物Example 174(专利号:US 20210299100A1)在AACR2023大会简单海报介绍了临床一期化合物IAG933(结构应该类似图2中的compound 174)的最新情况:
IAG933通过直接干扰YAP和TEADs的相互作用来抑制YAP/TAZ-TEADs PPI。这与目前的其他公司药物不同(比如Vivace和英硅智药),它们通过与TEAD的脂质口袋结合来抑制YAP/TAZ-TEADs PPI。
IAG933在体外和体内均显示出有效的抗肿瘤活性。它在携带NF2功能缺失或表达TAZ-融合的癌症模型中显示出强大的抗肿瘤活性。此外,IAG933还与几种MAPK/KRAS抑制剂在非Hippo改变的模型中显示出协同作用,包括肺、胰腺和结肠癌。总体而言,这些结果为IAG933在Hippo突变癌症患者中的单药治疗以及在MAPK依赖性癌症中的联合治疗提供了合理的依据。
02
挑战不可能,
TEAD抑制剂研发难点分析
河马通路对YAP/TAZ的调节为抑制调控,其在肿瘤中的作用主要为肿瘤抑制,河马通路自身作为药物靶点存在策略不可行性。
直接靶向YAP/TAZ-TEAD相互作用的药物存在一些挑战。
例如,维替泊芬和共价抑制剂等药物具有毒副作用,并且会导致脱靶效应。多肽药物比如super-TDU等药物分子较大,限制了其给药途径,并且毒副作用也不清楚。靶向结合界面3的直接抑制TEAD药物,如氟灭酸及其共价抑制剂衍生物,相对安全成熟,但其具体作用效果及机制尚不清楚,仍需进一步研究。另外文献中报道的很多小分子在细胞实验和活性很好,但动物实验效果不佳,有公司也因此暂停了TEAD管线的开发。
在针对TEAD同族蛋白1,2,3,4的选择性上小分子药物设计有很大挑战,比如Ikena公司的临床一期药物IK-930是一种Tead1特异性抑制剂,而Vivace的药物VT3989是一种泛Tead抑制剂。Ikena和Vivace的药物在临床试验中都显示出抗肿瘤活性。然而,Ikena的药物在猴子试验中没有发现毒性,而Vivace的药物在一些患者中引起了蛋白尿、肝酶升高和心肌病。
Ikena首席执行官马克认为,Ikena的药物比Vivace的药物更有针对性,因此更安全。然而,直到这两种药物都在患者身上生成足够的数据后,才能确定哪种药物更有效。
TEAD抑制剂全球药企在研情况
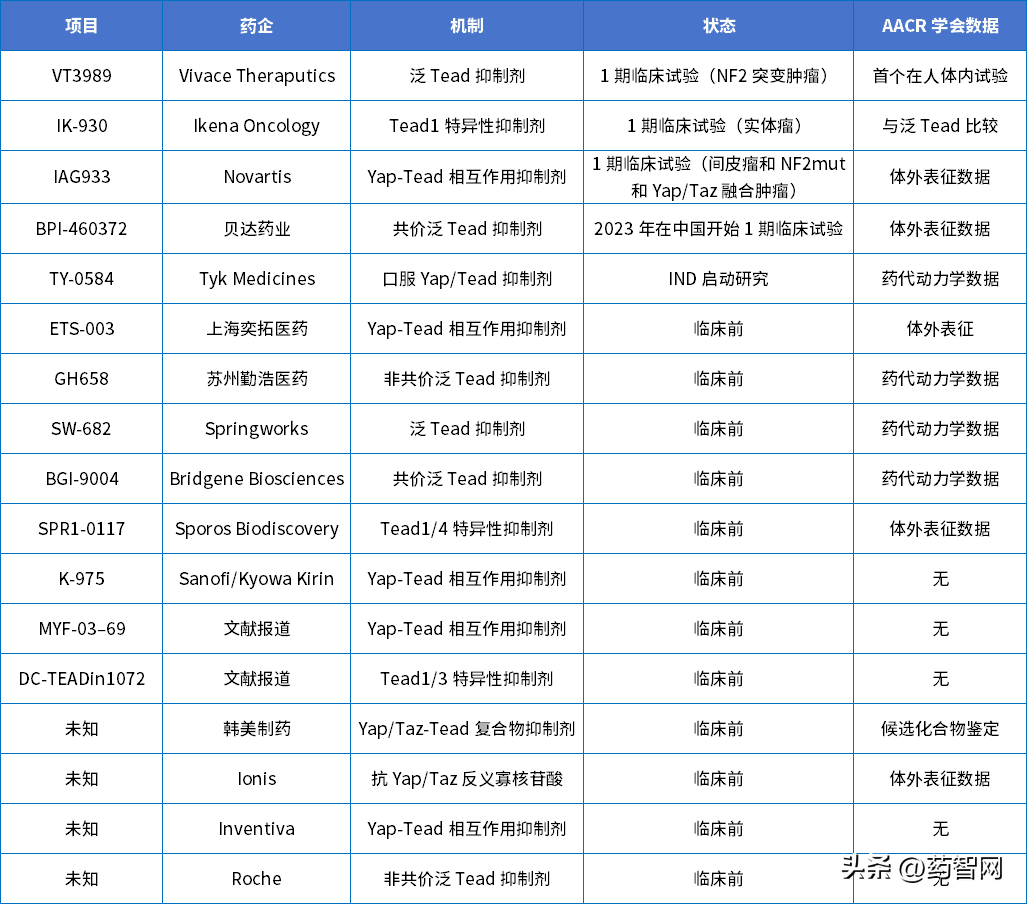
数据来源:参考资料6
总之,TEAD抑制剂是一种具有广泛潜在应用的新型药物,目前多款药品仍处于临床一期阶段,但其前景非常光明。随着TEAD抑制剂临床试验的推进,预计相关在研药品将在未来几年内上市,为患者带来新的治疗选择。
参考资料:
1.管教授最新综述:https://www.nature.com/articles/s41568-023-00579-1
2.诺华IAG933计算机药物设计论文:
https://pubs.acs.org/doi/10.1021/acs.jcim.3c00122
3.诺华IAG933相关药化论文:https://pubmed.ncbi.nlm.nih.gov/35950546/
4.最新TEAD共价抑制剂论文:
https://pubs.acs.org/doi/10.1021/acs.jmedchem.2c01548
5.默克MSC-4106设计论文并对比了目前主流TEAD抑制剂的活性和正对TEAD1-4的选择性:https://pubs.acs.org/doi/abs/10.1021/acs.jmedchem.2c00403
6.有关AACR大会TEAD相关管线:https://zhuanlan.zhihu.com/p/625321073
7.生物世界:国际著名生物学家管坤良教授回国,全职加入西湖大学,系统介绍其10篇代表性论文
免费领取药智数据VIP试用:https://vip.yaozh.com/introducemobile?tryout=1&ga_source=zimeiti&ga_name=yzw_wz
声明:本内容为作者独立观点,不代表药智网立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请联系maxuelian@yaozh.com。